专业文章
专利链接制度-原研药VS仿制药
发表于:2021-10-13 浏览量:

一、前言
2020年10月17日,第十三届全国人民代表大会常务委员会第二十二次会议通过修改《中华人民共和国专利法》的决定,自2021年6月1日起施行。
本次修正在第76条引入了专利链接制度:“药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围做出判决。国务院药品监督管理部门在规定的期限内,可以根据人民法院生效裁判做出是否暂停批准相关药品上市的决定。
药品上市许可申请人与有关专利权人或者利害关系人也可以就申请注册的药品相关的专利权纠纷,向国务院专利行政部门请求行政裁决。
国务院药品监督管理部门会同国务院专利行政部门制定药品上市许可审批与药品上市许可申请阶段专利权纠纷解决的具体衔接办法,报国务院同意后实施。”
本次修正在第76条的发布,提供了在仿制药批准前解决专利纠纷的框架。结合2020年9月11日,国家药监局、国家知识产权局发布《药品专利纠纷早期解决机制实施办法(试行)(征求意见稿)》;2020年10月29日,最高人民法院发布《最高人民法院关于审理涉药品上市审评审批专利民事案件适用法律若干问题的规定(征求意见稿)》;2020年11月27日,国家知识产权局发布《专利法实施细则修改建议(征求意见稿)》。在此基础上,《专利法》修改和相关办法意见征求意见发布意味着中国的专利链接制度即将落地。
二、什么是专利链接制度:
所谓专利链接,指仿制药上市批准与创新药品专利期满相“链接”,即仿制药注册申请应当考虑先前已经上市的药品的专利情况,从而避免可能的专利侵权。
专利链接制度有两层含义:一是仿制药的上市申请审批与相应的药物专利有效性审核的程序链接;二是药品注册管理部门食品药品监督管理局与专利审批部门国家知识产权局的职能链接。
三、专利链接制度起源
所谓专利链接制度最早起源于美国1984年的《Hatch-Waxman法案》,并在其完善、发展过程中,包括了后期的《仿制药实施法》(1992年)、《医疗保险现代化法案》(2003年)、《生物制剂价格竞争与创新法案》(2010年)等法案,构成了专利链接制度体系。
而虽然中国相关法案还在征求意见稿,但依然可以看得出,中国的专利链接制度很大程度借鉴了美国的《Hatch-Waxman法案》。下面,我们将详细介绍美国专利链接制度核心内容,以及中国专利链接制度(征求意见稿)与美国的异同。
四、美国专利链接的核心内容:
(1)信息公开制度
即橘皮书制度,原研药企业在申请新药上市许可时,需提交与该药有关的专利信息,并通过橘皮书向社会公布,未列入橘皮书的专利不得在链接程序中主张权利。
根据Hatch-Waxman法案,原研药企在向FDA递交新药上市许可申请(NDA)时,需要同时提供与该药物相关的专利信息,例如,相关专利的专利号、专利到期日等。在NDA申请被FDA批准后,申请人提交的相关专利信息将会被FDA披露在橙皮书中。橙皮书中披露的专利信息将为仿制药企开发仿制药、进行ANDA、或预先判断是否侵犯专利权等提供参考。为了防止橙皮书中专利信息混乱以及滥用,FDA规定可以列入橙皮书的专利包括:活性化合物、配方、组合物、药物用途;不能列入橙皮书的专利包括:制造及工艺方法、外包装专利、代谢物、中间体等。FDA会定期修改橙皮书,其中专利权被无效或超过专利期和市场独占期的药物专利将从橙皮书的专利信息列表中删除。
(2)专利声明制度
仿制药申请人应当随申请向FDA提交有关专利状况声明,具体包括没有相关专利登记在橘皮书上,橘皮书上登记的专利已过期,申请人将在橘皮书所列专利到期后才开始制造、销售仿制药,以及橘皮书中所列专利无效或申请人并不侵犯橘皮中登记的专利权。
在递交ANDA时,仿制药企需要根据橙皮书的规定,递交以下4种声明之一:
1) 橙皮书中没有相关药物的专利登记信息;
2) 该药物在橙皮书中的专利期限已经届满;
3)该药物的专利届满日,同时声明在药物专利到期前不上市;
4)相关药物的专利无效或仿制药不侵犯相关药物的专利权。
对于声明1)或2),FDA会按照正常程序批准ANDA申请。对于声明3),FDA通常会在相关专利期届满后批准该ANDA申请。对于声明4),如果橙皮书中参比药物的专利期没有届满,但仿制药企不想等到专利到期而进行仿制药上市申请,则需要提交该项声明(该声明也被称为“专利挑战”)。
(3)拟制侵权制度
对于提出“专利挑战”声明的申请,应提交证明材料,并通知专利权人,如果专利权人在接到通知后45天内向法院提起诉讼的,FDA将停止审批30个月。
如果橙皮书中参比药物的专利期没有届满,但仿制药企不想等到专利到期而进行仿制药上市申请,则需要提交该项声明。根据Hatch-Waxman法案规定,启动该声明后,将会在以下时间节点发生以下事件:
①20天,ANDA申请人应在提出申请后20天内通知专利权人或者新药证书持有人,通知函内容主要包括向FDA提交的生物等效性报告、申报日期、陈述不侵犯专利权或专利无效的理由和法律依据。
②45天:专利权人或者新药证书持有人在收到通知后的45天内可向FDA联邦法院提出专利侵权的诉讼,要求裁定相关专利有效,或者仿制药企侵权。若45天内,专利权人或者新药证书持有人未向法院提起诉讼,FDA 将不中止对ANDA申请的审查,继续批准符合条件的仿制药的上市,其后发生的专利侵权纠纷,FDA 将不承担责任。
③30个月(即遏制期):专利侵权诉讼启动后,FDA将给予30个月时间让双方解决诉讼纠纷,同时,ANDA申请将自动推延30个月。若在30个月之内专利期届满或法院判定专利无效或仿制药不侵权,且ANDA符合审批要求则会被FDA批准生效。若该诉讼在30个月内仍未解决,则FDA会对符合要求的ANDA颁发临时性批件;其后,若ANDA申请人胜诉,则FDA将颁发正式批件;若ANDA申请人败诉,则该临时批件撤销,且ANDA申请人还需承担相应的赔偿责任。为了避免遏制期被滥用,Hatch-Waxman法案规定ANDA仅有一次30个月遏制期。
(4)侵权豁免制度
仿制药申请人以注册为目的在原研药专利期限内进行研发不认为侵权,即Bolar例外。
Bolar例外是指“在美国制造、使用或销售药品,需要依照联邦药品管理法的规定提交相关研发信息,仅仅为满足联邦法律对提交数据的规定而进行的相关行为,如在美国本土制造、使用、许诺销售或销售专利药品或将专利药品进口至美国本土不认为是专利侵权行为”。Bolar例外为仿制药在新药专利期届满前尽快获得上市审批所需的数据提供了法律依据,缩减了仿制药进入市场所需的时间,激发了仿制药企的积极性,取消了原研药专利期的变相延长。
受Roche公司诉Bolar公司药品专利侵权一案影响,为了使得仿制药能够及早上市,允许仿制药制造商在药品专利到期前着手研制专利药的仿制品,即仿制药可以在专利过期前以研究目的进行样品生产、试验,以通过FDA的审批程序。此条款体现在美国法典25U.S.C.A§271(e)(1)条款,且经修订将范围扩大到了兽药、医疗器械等FDA管辖产品。
(5)简化申请制度
仿制药上市申报无需重复进行新药申请已证明的安全性、有效性研究,只需进行生物等效性研究。
在Hatch-Waxman法案以前,仿制药企向FDA申请仿制药上市时,也需要对仿制药进行安全性及有效性试验;而在该法案通过后,仿制药企只需要证明仿制药与参比药物(即原研药)具有生物等效性,提交简化新药申请(ANDA),以证明仿制药与原研药具有相同的活性成分、生物等效性、生产规程、剂型等。
(6)遏制和保护期制度
对不同类别仿制药赋予不同的数据保护和市场独占期保护,首仿药企业即第一家成功挑战原研药专利并获得上市许可的仿制药企业将享有180天市场独占期,其间不会再批准其他仿制药上市申请。
在该独占期内,首仿药企可以凭借低廉价格快速抢占原研药市场份额,其极大的激励了仿制药企。但是当出现以下情况时,首仿药企将丧失180天市场独占期:通过ANDA审查后75日后或提出ANDA申请30个月内产品未上市的;撤销ANDA申请的;在对ANDA审查时相关专利保护期届满的。
(7)专利期延长制度
最长可延长5年,从药品批准之日起,专利延长期加上市后专利剩余期总计不能超过14年。
(8)数据保护制度
根据FDA的规定,NDA申请者必须通过临床前试验和临床试验得到大量数据,以证明药品是安全、有效、质量可控的。通常这样的试验需要耗费大量的人力与物力。为了促进药品研发企业的积极性,Hatch-Waxman Act设定了创新药数据保护制度,对NDA申请者提供的相关数据提供数据保护。在数据保护期间,不受理任何仿制药的注册申请。但当数据保护期过期后,任何人都可以依据其数据提出ANDA,以节省药品研发成本。
对于不同情况FDA提供不同的数据保护期限:一是,对于新化学实体提供5年数据保护;二是,对于新临床研究数据提供3年数据保护。孤儿病药可以获得7年数据保护期;儿科药则可以在上述基础上额外增加6个月。在数据保护期内,FDA不再受理相同的仿制药上市申请,但仿制药申请人自行取得的试验数据除外。
从以上核心内容,不难看出,专利保护期延长、数据保护期、30个月遏制期等制度保证了原研药企的利益,提高了原研药企的研发回报。橙皮书、Bolar例外、仿制药简化申请、180 天市场独占期等制度保障了仿制药企的利益,缩短了仿制药上市的时间、降低了仿制药的成本。
五、中美差异:
(1)是否主动通知专利权人
从目前征求意见稿内容看,中国专利链接无需主动通知专利权人和新药上市许可人。因此,相关专利权人/新药上市许可人在专利期内需要密切关注药监部门对于仿制药申请的公示,以防止错过45天的诉讼提起时间。
(2)审批等待期不同
根据美国《Hatch-Waxman法案》,美国FDA的仿制药申请暂停时间(成为遏制期)为30个月,如果任何一方没有合理配合诉讼过程造成延误,法院有权缩短或延长等待期。相对于美国而言,中国相关征求意见稿9个月的等待期还包含二审判决时间,对于判决带来较大挑战。
(3)专利挑战市场独占期时长不同
征求意见稿规定市场独占期为12个月,是美国独占期的约2倍时间。
这主要是考虑到中美药品购买方的差异。在美国,药品的主要采购方是PBM(药品福利管理机构),流程相对简单。如巴尔制药挑战礼来氟西汀专利成功后,PBM公司Merck-Medco第一个星期就把原研药换成仿制药。在中国仿制药上市往往还要经历各级挂网和进院环节,药品实际进入临床的时间大大慢于美国市申请。
(4)争议解决方式
在中国,专利权人/新药上市许可持有人可以在北京知识产权法院提起民事诉讼,也可以在国家知识产权局提起行政裁决,行政裁决的结果可以上诉到法院。如果先申请行政裁决,获得受理后再向法院起诉,可以同时进行两个并行的第76条诉讼。如果先向北京知识产权法院起诉并获得受理,那么国家知识产权局将不再受理之后提出的行政裁决申请。
此外,第76条诉讼仅用于确定仿制药是否落入专利保护范围,而不对专利有效性进行裁决。如果仿制药申请人想要挑战专利有效性,需要在国家知识产权局专利局复审和无效审理部发起无效宣告请求程序。
在美国,对于第四类声明,专利权人/新药上市许可持有人可以在联邦地方法院对仿制药申请人提起专利侵权诉讼。在法院诉讼中,仿制药申请人既可以对专利有效性提出挑战,也可以对是否侵权提出异议。除此以外,仿制药申请人也可以在联邦法院民事诉讼开始之前或过程中,在美国专利和商标局(USPTO)请求对专利启动另外的复审程序,以此挑战专利的有效性。
六、与76条相关的诉讼流程和有关要求
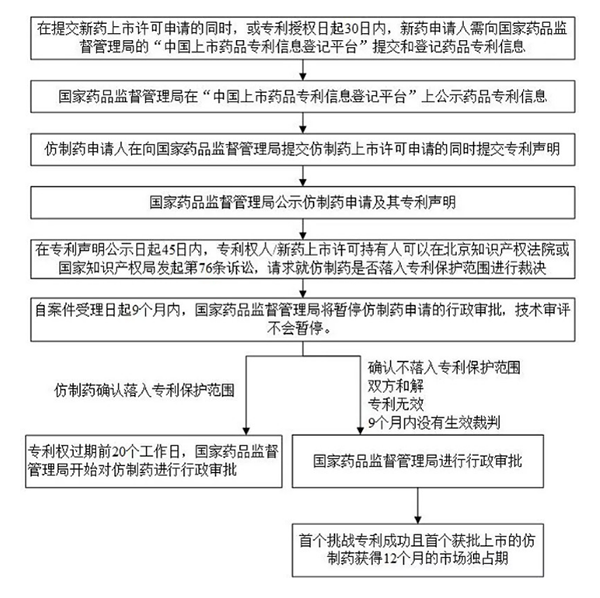
七、总结
可以说,专利链接制度是基于药品注册与专利权之间的关系及相互影响的制度设计,实质是在鼓励创新与促进仿制药上市之间寻找平衡点,在专利权(独占性)和健康权(可及性)之间寻找一个平衡点。
专利链接制度平衡创新药企业和仿制药企业之间的利益关系,一方面允许仿制药企业在原研药专利到期之前展开仿制工作而不必担心因研究和申报而造成的专利侵权行为,另一方面鼓励仿制药企业发起专利挑战,从而促成仿制药尽快上市。在保护药品创新的同时鼓励和促进仿制药尽早上市,从而让患者尽快使用上更便宜的仿制药,并促进整个医药行业有序良性竞争、发展。
参考文章来源:
1、张鹂,一文读懂:专利链接的前世今生
https://www.sohu.com/a/218088184_100011502
2、封丽、杜宜聪、蒋洪义,中美药品专利链接制度比较
https://xueqiu.com/9408056484/174591618
3、火石产业大脑,速看!深度解读中国专利链接制度!
https://zhuanlan.zhihu.com/p/370141108
4、金石智权-知识产权,各国专利链接制度有何特色?
https://zhuanlan.zhihu.com/p/330452151
